Tailles des Nanobulles et Leurs Propriétés Physiques
Tailles de bulles
Bulles ultrafines, nanobulles, oxygène dissous, microbulles, millibulles, le monde des bulles peut parfois être déroutant. Les bulles sont des cavités remplies de gaz dans de l'eau, elles restent en suspension dans l'eau. Le terme oxygène dissous désigne des molécules d'oxygène non liées dans de l'eau. L'oxygène non lié se comporte différemment et il est important de comprendre la différence entre un gaz dissous et une cavité gazeuse.

Les millibulles sont des bulles de moins d'un millimètre de diamètre, mais de plus d'un micromètre de diamètre. Les microbulles sont de petites bulles d'un diamètre compris entre 10 et 50 μm et de taille décroissante pour finalement disparaître sous l'eau. Les nanobulles, ou bulles officiellement ultrafines, sont des bulles de gaz miniatures dans des liquides, d'un diamètre inférieur à 200 nm, et présentent plusieurs propriétés physiques uniques, différentes de celles des millibulles ordinaires. Les nanobulles restent stables dans l'eau pendant longtemps en raison de leur surface chargée négativement qui peut être calculée par le potentiel zêta, contrairement aux millibulles qui grossissent, montent rapidement et éclatent à la surface de l'eau.
Des bulles plus petites ont une meilleure réactivité par agrandissement de surface

Dans le même volume d'eau, la surface de contact entre les bulles dans de l'eau remplie de petites bulles est beaucoup plus grande que dans l'eau remplie de grosses bulles. L'augmentation de la surface de contact améliore par exemple les activités de bactéries aérobies dans le liquide en utilisant de l'oxygène gazeux ou encore les activités de bactéries anaérobies en créant des bulles d'azote. De plus l'efficacité des réactions chimiques entre le gaz fourni et les ingrédients liquides est augmentée. Dans les applications pratiques, le CO2 est plus facilement disponible pour les algues et l'O2 est plus facilement disponible pour les racines des plantes ou les bactéries aérobies dans l'assainissement des sols.
Dans l'image, lorsque nous regardons cela d'un point de vue mathématique nous arrivons à la conclusion suivantes: lorsqu'elles sont générées, de petites bulles peuvent être créées à des concentrations plus élevées que des bulles plus grosses. La surface d'un volume de bulles est inversement proportionnelle au diamètre des bulles; ainsi, un ml de bulles de 100 nm de diamètre (2x10.15 bulles) a 1000 fois plus de surface (240 m2) qu'un ml de bulles de 0,1 mm (2x10.6 bulles, 0,24 m2).
Les 3 composants de la bulle
Les bulles ont 3 composants, la phase gazeuse, le matériau de coque et la phase aqueuse ou la phase liquide. La phase gazeuse est le gaz à l'intérieur de la bulle, qui est un gaz unique ou un mélange gazeux. Le matériau de la coque, de l'eau ou un liquide entourant la phase gazeuse. La formation de bulles et les propriétés mécaniques des bulles dépendent de la propriété du matériau de la coque. Le dernier composant est constitué de la phase aqueuse, la solution liquide ou combinée entourant le matériau de coque.
De plus, les fines bulles dont la surface est électriquement chargée sont capables de générer des radicaux libres lors de l'effondrement des microbulles. Certains chercheurs ont aussi rapporté que les microbulles d'air étaient pseudo-élastiques et sphériques dans les solutions aqueuses. En ce qui concerne les propriétés dynamiques des fluides, les bulles ont une faible vitesse de montée dans la phase liquide et une faible réduction de la résistance au frottement.
Les bulles dans de l'eau pure sont chargées négativement. Le potentiel zêta mesuré dans l'eau avec de fines bulles d'oxygène était de -45 mV à -34 mV tandis que le potentiel mesuré avec de fines bulles d'air était un peu plus petit avec -20 mV à -17 mV. La grande surface spécifique et la surface chargée permettent aux minuscules bulles d'absorber efficacement les molécules chargées opposément et/ou les petites particules.
Tension superficielle des microbulles et pression de gaz
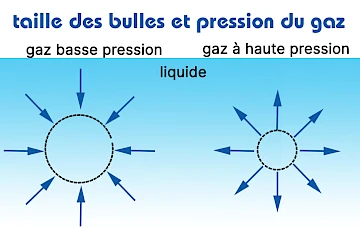
La pression du gaz à l'intérieur d'une petite bulle est plus élevée que dans une grosse bulle, donc la tension superficielle d'une petite bulle est également plus élevée. Pour cette raison, le gaz d'une petite bulle se dissout plus rapidement que celui d'une grosse bulle. Une petite bulle monte plus lentement que les grosses bulles vers le haut de la surface de l'eau, en raison de ce temps supplémentaire, le transport du gaz de la bulle au liquide est plus efficace. Les petites bulles coalescent moins (collent moins ensemble) que les grosses bulles, ce qui est bénéfique car lorsque les bulles grossissent, elles remontent plus rapidement à la surface, ce qui leur donne moins de temps pour le transport du gaz.
Dans le tableau ci-dessous, des exemples sont donnés de la pression à l'intérieur de la bulle en fonction de la taille de la bulle, les calculs sont basés sur l'équation de Young-Laplace.
Diamètre d'une bulle versus la pression à l'intérieur de la bulle dans l'eau
| Diamètre d'une bulle | Pression à l'intérieur de la bulle dans l'eau |
|---|---|
| 1 mm | 1.003 atm |
| 100 μm | 1.03 atm |
| 10 μm | 1.29 atm |
| 1 μm | 3.9 atm |
| 500 nm | 5.8 atm |
| 300 nm | 9.7 atm |
| 200 nm | 14.6 atm |
| 100 nm | 29.7 atm |
Le diamètre des bulles dans l'eau se reflète dans la flottabilité et le taux de montée. La vitesse de montée dépend des propriétés de la solution, et le nombre de Reynolds correspond à environ 1 à environ 100 μm de diamètre. De plus, dans le cas de Re < 1, la loi de Stokes s'adapte bien car les bulles se comportent comme des boules en raison des conditions de flux à l'interface des bulles globulaires. Sur la base de la loi de Stokes, le tableau donne 3 exemples de différentes tailles de bulles et la vitesse de montée d'une bulle dans l'eau. Étant donné que les bulles ultrafines sont si petites et se déplacent de manière aléatoire dans le liquide, la loi de Stokes ne leur est pas applicable.
Diamètre d'une bulle versus la vitesse de montée de la bulle dans l'eau (v/s)
| Diamètre d'une bulle | Vitesse de montée de la bulle dans l'eau (v s) |
|---|---|
| 100 μm | 5440 μm / s |
| 10 μm | 54.4 μm / s = 19.6 cm/h |
| 1 μm | 0.544 μm / s = 2.0 mm/h |
Il est essentiel de comprendre les propriétés physico-chimiques d'un composé telles que la solubilité, la stabilité, la définition de la forme, les propriétés à l'état solide, le coefficient de partage et les constantes d'ionisation. Parmi les caractéristiques physico-chimiques des micro-et nanobulles, il y a la grande surface spécifique et la forte pressurisation du gaz à l'intérieur de la bulle. Ces deux caractéristiques confèrent à ces bulles une grande capacité de dissolution des gaz. Plus la taille des bulles est petite, plus les valeurs de pO2 de la pression d'oxygène dans l'eau sont élevées, ce qui suggère que les nano-bulles augmentent les valeurs de pO2 dans l'eau dans une plus grande mesure que celles des microbulles (10 à 50 micromètres de diamètre).
Pourquoi les bulles ultrafines (nanobulles) vivent-elles si longtemps ?
Dans des conditions de laboratoire, il est possible que les bulles puissent être conservées pendant 3 à 6 mois. Dans les applications réelles cependant, cette période de conservation est beaucoup plus courte. La raison la plus probable de la longue durée de vie des bulles ultrafines est que l'interface gaz/liquide des bulles ultrafines est chargée, introduisant une force opposée à la tension superficielle, ralentissant ou empêchant ainsi leur dissipation. Dans une solution électrolytique, les ions positifs se concentrent autour du noyau du gaz en raison de sa surface chargée négativement et agissent comme des coquilles qui empêchent le gaz de se disperser (phénomène de relargage). En raison de cette caractéristique du comportement des ions, les bulles ultrafines restent stables pendant plus de 6 mois dans une solution électrolytique.
Frequently Asked Questions!
Quelle est la différence entre les milli-bulles, les micro-bulles et les nanobulles (bulles ultrafines) ?
Les milli-bulles ont un diamètre inférieur à 1 mm mais supérieur à 1 μm. Les microbulles vont de 10 à 50 μm et rétrécissent et disparaissent progressivement sous l'eau. Les nanobulles - officiellement appelées bulles ultrafines - ont un diamètre inférieur à 200 nm et possèdent des propriétés physiques uniques, notamment une stabilité à long terme dans l'eau grâce à leur surface chargée négativement.
Quelle est la différence entre l'oxygène dissous et les nanobulles ?
L'oxygène dissous se compose de molécules d'oxygène non liées dispersées dans l'eau, tandis que les nanobulles sont des cavités remplies de gaz (bulles) en suspension dans l'eau. Ces deux formes se comportent différemment : le gaz dissous interagit librement avec le liquide au niveau moléculaire, tandis que les nanobulles maintiennent une interface gaz-liquide distincte avec des propriétés électrochimiques uniques.
Pourquoi les petites bulles ont-elles une meilleure réactivité que les grosses ?
Les petites bulles ont une surface totale beaucoup plus grande par rapport à leur volume. Mathématiquement, 1 ml de bulles de 100 nm a 1 000 fois plus de surface (240 m²) que 1 ml de bulles de 0,1 mm (0,24 m²). Cette surface de contact élargie améliore considérablement l'efficacité du transfert de gaz et les taux de réaction chimique entre le gaz et le liquide environnant.
Quels sont les trois composants d'une bulle ?
Une bulle se compose d'une phase gazeuse (le gaz à l'intérieur de la bulle, qui peut être un gaz unique ou un mélange), d'un matériau d'enveloppe (l'interface entre le gaz et le liquide qui détermine les propriétés mécaniques de la bulle) et d'une phase aqueuse ou liquide (le liquide ou la solution qui l'entoure). Les propriétés du matériau de l'enveloppe régissent la formation, la stabilité et le comportement des bulles.
Pourquoi une vitesse de remontée des bulles plus lente améliore-t-elle l'efficacité du transfert de gaz ?
Plus une bulle reste longtemps en contact avec le liquide qui l'entoure, plus le gaz a le temps de se dissoudre à la surface de la bulle. Les petites bulles coalescent également moins que les grosses, ce qui signifie qu'elles ne fusionnent pas pour former des bulles plus grosses qui remonteraient plus vite.
Quelles sont les applications pratiques qui bénéficient le plus de l'agrandissement de la surface des nanobulles ?
La surface élevée des nanobulles améliore l'activité bactérienne aérobie (utilisant l'oxygène), l'activité anaérobie (utilisant l'azote) et l'efficacité des réactions chimiques entre les gaz dissous et les ingrédients liquides. Parmi les exemples pratiques, on peut citer l'acheminement du CO₂ vers les algues dans les systèmes de culture et l'acheminement de l'O₂ vers les racines des plantes ou les bactéries aérobies dans les projets d'assainissement des sols.
Les nanobulles peuvent-elles générer des radicaux libres et quelle est l'importance de ce phénomène ?
Oui - les fines bulles dont la surface est chargée électriquement peuvent générer des radicaux libres lors de l'effondrement des microbulles. La génération de radicaux libres est importante pour les processus d'oxydation avancés (POA) dans les applications de traitement et de désinfection de l'eau, en particulier lors de l'utilisation d'ozone ou de nanobulles d'oxygène pour décomposer les contaminants.







